- Anúncios -
O que significa common?
Qual o significado de common? Essa palavra, tão comum no dia a dia, possui diversos significados. Comum pode se referir a algo que é frequente, ordinário, ou mesmo simples. No entanto, também pode ser usado para indicar a comunhão entre pessoas, o compartilhamento de ideias e objetivos em comum. Uma palavra tão simples, mas tão cheia de significados e possibilidades.
O que significa attend?
No vasto mundo da linguagem, as palavras são como tesouros escondidos esperando para serem descobertos e compreendidos. E hoje, vamos mergulhar no significado da palavra "attend". Nossa jornada nos levará a uma compreensão mais profunda do verbo, uma das peças fundamentais que compõem o tecido da língua portuguesa. Prepare-se para explorar e desvendar o significado oculto de "attend" e sua…
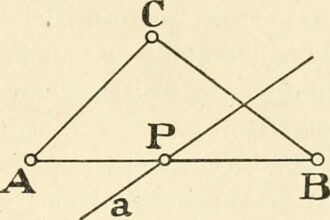
O que significa angle?
Ângulo, uma palavra tão simples, mas com um significado tão profundo. Ele é a medida da abertura entre duas linhas ou superfícies, uma forma de expressar a forma como as coisas se encontram em um determinado espaço. Ao entender o ângulo, entendemos melhor o mundo ao nosso redor e como ele se encaixa em nosso universo matemático. Mas mais do…
Medicina
O que significa ter síndrome de StevensJohnson?
A síndrome de Stevens-Johnson é um pesadelo que invade o corpo e…

Create an Amazing Newspaper
Siga-nos
O que significa derivada na matemática?
Derivada na matemática é como uma chave mágica que nos permite desvendar…
O que significa algarismo na matemática?
O que significa algarismo na matemática? Quando nos deparamos com essa palavra…
O que significa subtração?
A subtração é um conceito matemático que pode parecer complicado à primeira…
O que significa equação diferencial na matemática?
Resolver equações diferenciais pode ser desafiador para muitos estudantes de matemática, mas…
O que significa axioma na matemática?
Você já se perguntou o que significa axioma na matemática? Bem, prepare-se…
O que significa divisão?
Ao falarmos sobre divisão, mergulhamos em um mundo repleto de possibilidades e…
O que significa cosseno na matemática?
O cosseno é uma das grandezas fundamentais da matemática, mas seu significado…
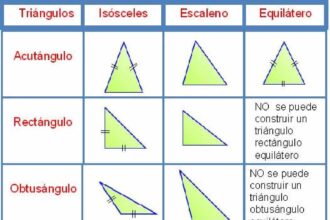
O que significa escaleno?
Escaleno, uma palavra que encerra mistério e equilíbrio. Entre os triângulos, este…

Create an Amazing Newspaper
Conteúdo patrocinado
O que significa capitalismo?
O que significa capitalismo? É um conceito que se desdobra em um verdadeiro oceano de interpretações e debates. Desde sua origem na Revolução Industrial até os dias atuais, o capitalismo abrange os pilares da propriedade privada, da livre iniciativa e do mercado competitivo. Mas, será que esse sistema econômico tem se mostrado eficiente e sustentável para todos? Exploraremos essas questões e muito mais neste artigo, mergulhando nas profundezas desse complexo sistema que molda nossa sociedade contemporânea.
O que significa SUS?
O Sistema Único de Saúde, mais conhecido como SUS, é um verdadeiro guardião da saúde do povo brasileiro. Com seus princípios de universalidade, integralidade e equidade, o SUS garante acesso…
Top Autores
Stay Up to Date
Subscribe to our newsletter to get our newest articles instantly!